Pengesanan awal Ganoderma
Satu tinjauan menunjukkan BSR berlaku pada lebih daripada 59.6% (632 daripada 1046 ladang yang ditinjau pada tahun 2010) ladang kelapa sawit di Malaysia.
Malangnya, banyak penanam terutamanya pekebun kecil tidak menyedari bahawa kelapa sawit mereka dijangkiti Ganoderma, walaupun dalam situasi yang kehadiran penyakit itu jelas kelihatan.
Beberapa kaedah untuk pengesanan awal Ganoderma pada pokok kelapa sawit telah dibangunkan, iaitu seperti berikut:
- Berasaskan kultur. cth. Penggerudian dan Medium Pemilih Ganoderma (GSM)
- Kaedah molekular, cth. PCR
- Biosensor, cth. tomografi GanoSken
Kaedah penggerudian dan GSM
GSM boleh digunakan untuk mengesahkan kehadiran penyakit Ganoderma pada pokok kelapa sawit. Dengan GSM, jangkitan kelapa sawit tanpa sebarang gejala luaran yang jelas (pokok kelapa sawit tanpa gejala) dapat dikesan menggunakan teknik penggerudian. Kajian menunjukkan bahawa 10-16% kelapa sawit yang kelihatan sihat sebenarnya sudah dijangkiti oleh kulat Ganoderma.

Pokok kelapa sawit yang disyaki terkena jangkitan digerudi pada kedalaman 30 cm pada pangkal pokok menggunakan mata gerudi (diameter 11 mm, panjang 45 cm) yang dipasang pada gerudi enjin
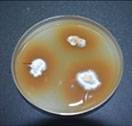
Tisu batang diletakkan pada GSM, diinkubasi selama 5-8 hari. Miselium putih yang tumbuh daripada tisu kemudian dipindahkan ke piring agar dekstrosa kentang (PDA).

Kultur piring petri Ganoderma. Pengenalpastian berdasarkan ciri morfologi menggunakan mikroskop.
Kaedah tomografi GanoSkenTM
Tomografi merujuk kepada pengimejan keratan rentas objek sama ada daripada penghantaran atau data pantulan yang dikumpul dengan cara mendedahkan objek yang dikaji kepada sumber gelombang dari pelbagai arah. Teknologi tomografi adalah kaedah tak invasif yang direka untuk menilai pereputan dan degradasi pokok. Peralatan yang terlibat termasuklah Pengesan Bunyi dan perisian Tomografi yang dipanggil GanoSken<sup>TM</sup>. Pengesan bunyi dipasang di sekeliling lilitan batang kelapa sawit yang sedang dikaji. Gelombang bunyi dipancarkan pada satu alat pengesan bunyi dan masa lantunan bunyi tersebar dari pemancar kepada alat pengesan bunyi yang lain dikira. Garis bunyi ini kemudiannya digunakan untuk membina imej tomografi batang pokok. Pengesanan bersama-sama dengan lokasi serta saiz pereputan dan degradasi membolehkan pakar memutuskan rawatan penyakit yang berkesan pada batang kelapa sawit.
Penilaian lapangan telah dijalankan ke atas 30 keratan rentas batang kelapa sawit yang dikelaskan kepada dua kumpulan: sawit yang kelihatan sihat (H) dan sawit yang berpenyakit (dijangkiti) (I). Imej tomografi GanoSkenTM telah dihasilkan dan saiz serta tapak (lokasi) jangkitan Ganoderma pada batang kelapa sawit disahkan. Imej keratan rentas sebenar berkorelasi dengan imej tomografi. Kawasan perang gelap menunjukkan batang sawit utuh dan sihat, manakala kawasan ungu dan kehijauan menunjukkan jangkitan Ganoderma. Jangkitan Ganoderma pada batang kelapa sawit telah disahkan dengan menggunakan GSM.
Keputusan menunjukkan bahawa tomografi GanoSkenTM mampu mengesan dan mengenal pasti jangkitan Ganoderma pada pokok kelapa sawit yang kelihatan sihat (tanpa gejala). Tomografi GanoSkenTM mampu melakukan pengesanan awal jangkitan Ganoderma pada batang kelapa sawit terutamanya kelapa sawit yang kelihatan sihat.

Pengesanan Ganoderma menggunakan GanoSkenTM. Imej tomografi GanoSkenTM dihasilkan.
Molecular PCR-DNA method
The use of Polymerase Chain Reaction (PCR) technique for detection offers early detection and screening of pathogenic Ganoderma in oil palm.
MPOB has develop a forward primer, PER44-123 paired with a reverse primer LR1. The primers amplify partial ITS region of the ribosomal RNA and produce 580 bp amplified fragments. These primers are specific to pathogenic Ganoderma and only detect G. boninense, G. zonatum and G. miniatocinctum and shown not to detect other Ganoderma species such as G. tornatum, G. philippii, G. lucidum, G. weberianum, G. applanatum, G. oregonense, G. chalceum, G. pfeifferi, and G. resinaceum (Figure A) and other several other fungal/oomycetes species including fungus found on rotten palm parts (roots, stem and fruit bunches) and soil such as Aspergillus, Botryodiplodia, Gymnopilus, Fusarium, Marasmius, Pythium, Penicillium, Pycnoporus, Rhizopus, Rhizoctonia, Schizophyllum, Thielaviopsis, Trichoderma and Volvariella (Figure B).
Sensitivity of the primers for PCR was high, and DNA was detectable at concentrations as low as 10 pg(µl)-1.
Figure A. Specificity tests of PER44-123 and LR1 with DNA extracted from G. boninense and 11 other species of Ganoderma. Lane 1, G. boninense; Lane 2, G. philippii; Lanes 3-4, G. lucidum; Lane 5, G. weberianum; Lanes 6-7, G. applanatum; Lane 8, G. oregonense; Lane 9, G. chalceum; Lane 10, G. pfeifferi; Lanes 11-12, G. tornatum; Lanes 13-14, G. miniatocinctum; Lanes 15-16, G. zonatum; Lane 17, G. resinaceum and Lane 18, negative control of sterile distilled water. M is 50 bp DNA ladder.
Figure B. Specificity tests of primers PER44-123 and LR1 with DNA extracted from three species of Ganoderma and 14 fungi/oomycete. Lane 1, negative control of sterile distilled water; Lanes 2-18, Aspergillus sp., Botryodiplodia theobromae, Gymnopilus sp., Fusarium sp., Marasmius palmivorus, Pythium sp., Penicillium sp., Pycnoporus sp., Rhizopus sp., Rhizoctonia sp., Schizophyllum commune, Thielaviopsis paradoxa, Trichoderma sp., Volvariella sp., G. miniatocinctum, G. zonatum and G. boninense. M is 50 bp DNA ladder.






